光动力学治疗利用外部光照刺激光敏剂生成活性氧(ROS),实现肿瘤细胞的杀伤,具有非侵入性、时空可控性和低毒副作用的优点。然而,由于光进入组织的穿透深度有限,它在治疗深层病理组织方面的有效性受到限制。另一方面,声动力疗法(SDT)使用超声波(US)作为外部刺激来触发声敏剂来杀伤肿瘤细胞,具有超过10厘米的出色穿透深度。SDT优越的组织穿透深度可以克服PDT的局限性,使SDT和PDT的结合能够利用超声和光刺激的互补作用,实现最佳的治疗效果。然而,光敏剂和声敏剂都不可避免地通过血液循环扩散和分布到正常组织和器官。PDT过程中的光散射和和SDT所产生的气泡爆炸释放的强大能量会导致非特异性ROS的产生,对肿瘤邻近的健康组织的产生毒副作用。基于这个问题,公共卫生学院安菲菲课题组开展了一系列的探索工作。
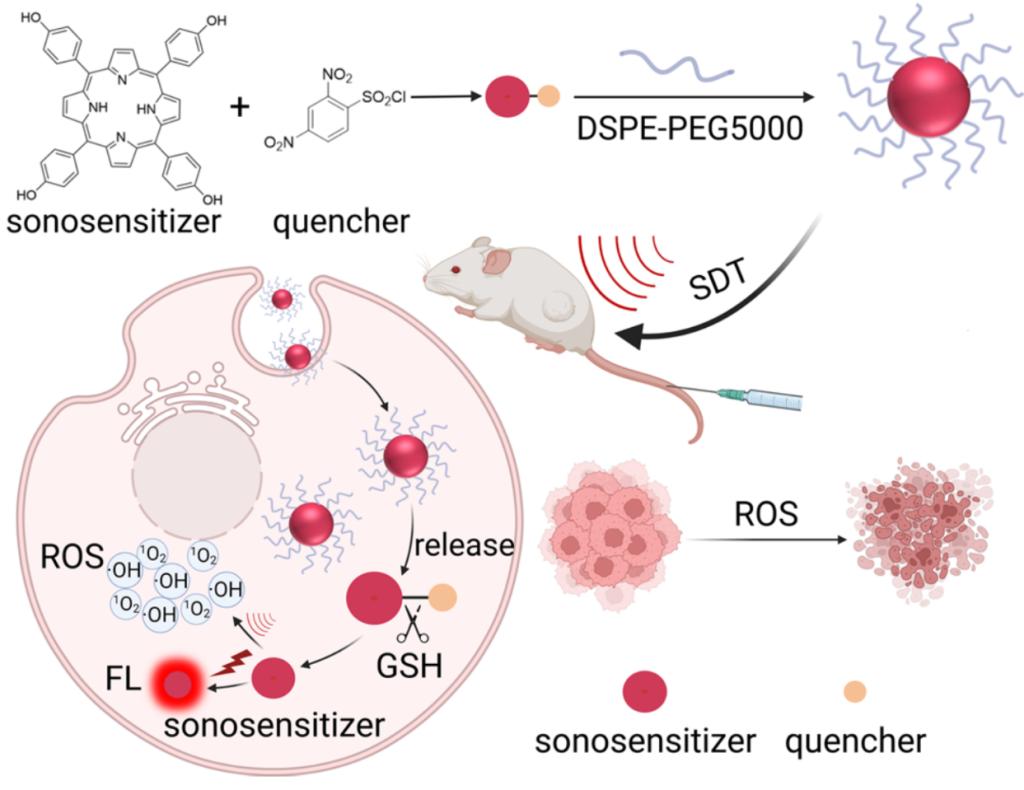
为了实现肿瘤区域的精准治疗,同时减少对健康组织的副作用,安菲菲课题组开发了前药设计策略,通过将淬灭基团附着在与四羟基卟啉(声敏剂)连接,构建了肿瘤微环境可激活的声敏剂前药。淬灭基团2,4-二硝基苯磺酰基通过分子内电子转移诱导荧光猝灭。实验证明,该前药在超声刺激下表现出受到抑制的荧光发射和ROS生成能力。但是,它可以被肿瘤内高浓度的谷胱甘肽(GSH)激活,同时开启增强的荧光发射和ROS生成能力。此外,通过构建自组装纳米颗粒负载前药,使其可以应用于体内。荧光成像结果显示,相比于药物组的小鼠(T/N = 2.3)和同时注射丁硫氨酸亚砜亚胺(BSO,一种GSH生成抑制剂)和前药组的小鼠(T/N = 3.4),前药组的小鼠表现出更高的肿瘤/背景比(T/N = 8.9)。改善T/N确保了前药在肿瘤部位的精准疗效,和减少对正常组织的损伤。最后,该前药在超声刺激下表现出有效的肿瘤生长抑制作用。
该研究成果以《GSH-Activated Porphyrin Sonosensitizer Prodrug for Fluorescence Imaging-Guided Cancer Sonodynamic Therapy》为题目发表在国际知名期刊《Advanced Functional Materials》(https://doi.org/10.1002/adfm.202300348)。该工作由西安交通大学博士生邓彩婷在硕士学习阶段和实验室成员共同完成,西安交大公共卫生学院安菲菲副教授和苏州大学程亮教授作为通讯作者,西安交大为第一作者单位。
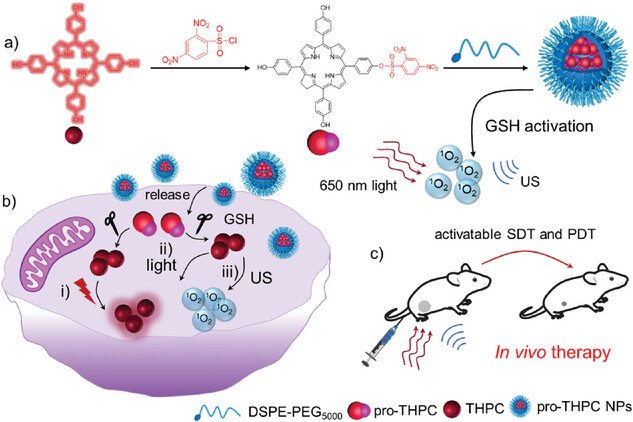
然而,由于卟啉在红/远红波长下吸收较弱,不能用于PDT。因此,安菲菲课题组继而设计了一种兼有声敏剂和光敏剂的双重致敏分子(THPC),并构建了肿瘤微环境可激活的前药(pro-THPC)。THPC在650 nm光照或US照射刺激下可产生ROS,而pro-THPC具有抑制荧光发射和ROS产生的显著作用。Pro-THPC可以被GSH激活,释放THPC,同时开启荧光发射、PDT和SDT的组合治疗能力。进一步将Pro-THPC负载于纳米颗粒,以实现体内应用。体内荧光成像显示,与“always-on”的THPC组(T/N = 2.9 ± 0.47)和BSO和pro-THPC共同给药组(3.2 ± 0.63)的小鼠相比,pro-THPC组表现出更高的T/N比(T/N = 5.2 ± 0.55)。pro-THPC的特异性激活策略在荧光成像中实现了较高的T/N比(T/N = 5.2 ± 0.55),使其可以精确地聚焦在肿瘤上,从而最大限度地减少对正常组织的毒副作用。体内研究进一步证明了pro-THPC的PDT和SDT的组合可以完全抑制肿瘤生长,同时能够显著降低皮肤光毒性。
该研究成果以《A GSH-Responsive Prodrug with Simultaneous Triple-Activation Capacity for Photodynamic/Sonodynamic Combination Therapy with Inhibited Skin Phototoxicity》为题目发表在国际知名期刊《Small》(https://doi.org/10.1002/smll.202400667)。该工作由博士生邓彩婷作为第一作者与实验室成员共同完成,西安交大基础医学院王福教授和公共卫生学院安菲菲副教授作为通讯作者,西安交大为第一作者单位。
以上工作得到了国家自然科学基金,陕西省自然基金,中国博士后科学基金,中央高校基本科研业务费和国家科学技术部外国专家项目等资助。