城市化进程中,空气污染引发的环境挑战与快节奏生活带来的社会心理压力,已成为威胁大众身心健康的两大关键因素,但既往针对两者叠加暴露对健康影响的研究证据较为薄弱。近日,本院吴少伟教授团队联合北京大学护理学院任利华副研究员团队,在环境与健康领域国际权威期刊Environment International发表创新成果,率先基于动物模型阐明二者协同损害心血管功能的关键分子机制,为应对这一双重威胁、完善人群健康风险防控体系提供了坚实的理论支撑与科学思路。

作为首要空气污染物——细颗粒物(PM₂.₅)的关键毒性组分,黑碳(black carbon,BC)主要源于交通尾气、煤炭及生物质燃料的不完全燃烧,凭借强吸附性和穿透性,其健康危害较PM₂.₅整体更显著。此外,社会心理压力已被证实是心血管疾病的重要风险因子。已有流行病学研究提示,社会心理压力可能放大空气污染的危害效应,但二者联合作用的内在生物学机理尚未阐明。为破解这一双重威胁的作用谜题,研究团队构建大鼠社会心理压力模型,结合模拟真实暴露场景的黑碳气管滴注方式,通过多指标、多维度实验设计,系统探究两大因素对心血管功能的联合影响,率先揭示“环境污染物-社会心理压力-表观遗传修饰”的协同危害路径。
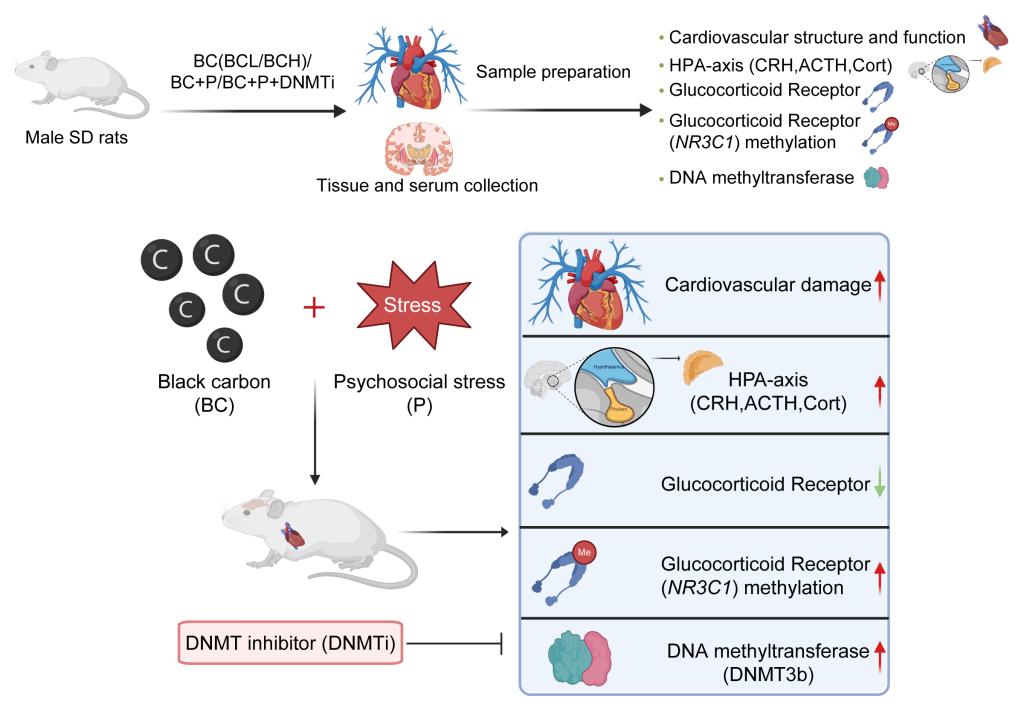
图1.实验设计与机制发现概念图
研究团队通过三轮递进式实验,逐步厘清黑碳与社会心理压力双重暴露的协同危害机制(图1)。研究首先明确了黑碳单独暴露的心血管毒性。实验结果显示,黑碳急性暴露可导致大鼠血压升高、心肌组织损伤,同时激活应激激素分泌通路,且该损伤效应随暴露剂量增加而呈递进式加重。随后,研究证实了黑碳与社会心理压力双重暴露的协同放大效应。与单一因素暴露组相比,黑碳叠加社会心理压力可显著加重大鼠心血管功能障碍,具体表现为心脏射血分数下降、心肌酶水平升高、血管舒缩调节功能紊乱加剧。团队进一步采用DNA甲基转移酶抑制剂(SGI-1027)验证核心机制,证实脑部海马体糖皮质激素受体(glucocorticoid receptor,GR)基因的表观遗传修饰为上述危害效应的关键早期事件。具体而言,双重暴露会诱导海马体GR编码基因NR3C1启动子区高甲基化,进而抑制GR蛋白表达,削弱对丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴的负反馈调节,打破应激激素分泌平衡,持续放大心血管损伤,且这一病理过程可通过DNA甲基转移酶抑制剂(SGI-1027)有效逆转(图2)。
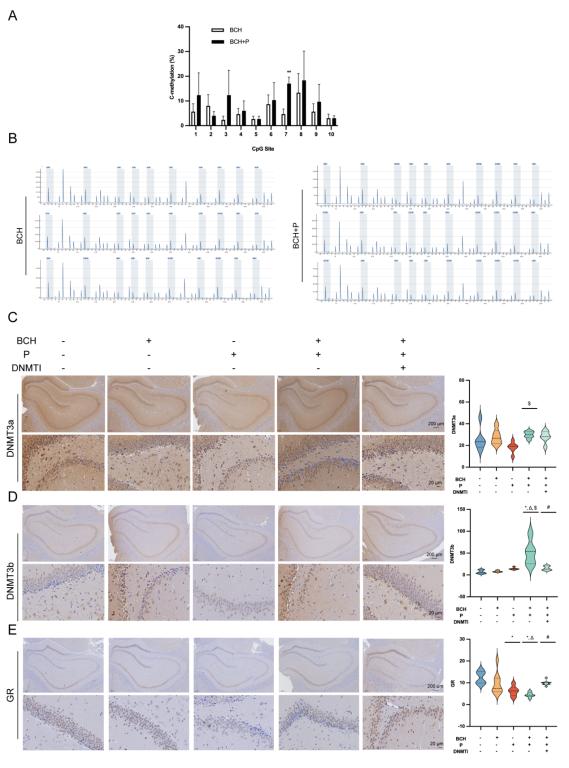
图2.黑碳、社会心理压力及DNA甲基转移酶抑制剂对海马体糖皮质激素受体甲基化水平、DNA甲基转移酶亚型及糖皮质激素受体蛋白表达的影响。(A)甲基化CpG位点;(B)甲基化检测结果;(C-E)大鼠海马组织中DNA甲基转移酶3a(C)、DNA甲基转移酶3b(D)及糖皮质激素受体(E)的免疫组织化学染色结果。实验组包括对照组(C1组)、高剂量黑碳暴露组(BCH组)、社会心理压力组(P组)、高剂量黑碳+社会心理压力组(BCH+P组),以及经DNA甲基转移酶抑制剂(DNMTi)预处理的对应各组,即C1+DNMTi组、BCH+DNMTi组、P+DNMTi组、BCH+P+DNMTi组。结果以平均值±标准差表示,组间比较采用单因素方差分析(one-way ANOVA),后续通过杜凯氏多重比较检验(Tukey's post hoc test)分析。*:与C1组比较,P<0.05;∆:与BCH组比较,P<0.05;$:与P组比较,P<0.05;#:与BCH+P组比较,P<0.05。
该研究突破单一环境因素暴露的研究局限性,创新性构建“环境污染物-社会心理压力-表观遗传修饰”三维交互研究范式,既丰富了交叉领域的研究内容,也为相关领域的机制探索提供了新的视角与思路。应用层面,该成果为应对空气污染与社会心理压力的双重威胁、开展城市人群心血管疾病精准防控提供了重要科学参考——在推进空气污染综合治理的同时,针对交通污染严重区域居民、高压职业人群等重点群体,辅以针对性社会心理干预措施,或可显著提升心血管疾病防控效能。同时,该成果为构建整合自然环境与社会心理因素的多维度健康风险评估体系提供了重要支撑,有利力推动环境健康风险评价从单一污染物评估向综合暴露评估转型。
本院吴少伟教授和北京大学护理学院任利华副研究员为该论文共同通讯作者,北京大学护理学院博士研究生胡寅初、本院助理教授兰阳和北京大学护理学院博士研究生李瑞琼为该论文共同第一作者。该研究得到国家自然科学基金、西安交通大学青年拔尖人才计划,以及生态环境部华南环境科学研究所环境污染健康风险评价重点实验室的项目资助。
阅读全文:https://doi.org/10.1016/j.envint.2026.110108